Andrea Garolla
Dipartimento di Medicina, Unità di Andrologia e Medicina Riproduttiva, Università di Padova
Lo sviluppo e il funzionamento dell’apparato genitale maschile, e dei caratteri sessuali secondari, dipendono da complessi meccanismi neuro-endocrini, integrati funzionalmente a livello dell’asse GnRH-gonadotropine-testicolo (GnRH-Gn-T), la cui integrità è necessaria per il normale svolgimento della capacità riproduttiva ed endocrina.
Le patologie che colpiscono la sfera sessuale e riproduttiva nell’uomo derivano da alterazioni anatomiche o funzionali di una o più di queste strutture, la cui conoscenza è quindi necessaria per un corretto inquadramento eziopatogenetico e terapeutico di questi pazienti.
Anatomia dell’asse GnRH-Gn-T
L’ipotalamo costituisce la parte ventrale del diencefalo, situata nella zona centrale interna ai due emisferi cerebrali. Comprende numerosi nuclei, che attivano, controllano e integrano i meccanismi autonomici periferici, l’attività endocrina e molte funzioni somatiche, quali termoregolazione, sonno, bilancio idro-salino e senso della fame. Due nuclei ipotalamici (sopra-ottico e para-ventricolare) sono collegati direttamente alla porzione posteriore dell’ipofisi tramite neuroni che formano il fascio ipotalamo-ipofisario, essenziale per il controllo del sistema endocrino (fig 1).
Figura 1. Anatomia dell’asse GnRH-Gn-T (modificato da Home Fertility Network)
L’ipofisi è una ghiandola endocrina posta alla base del cranio, nella fossa della sella turcica dell’osso sfenoide, in prossimità del chiasma ottico. Consta di due lobi, il lobo anteriore (ipofisi anteriore o adeno-ipofisi) e il lobo posteriore (ipofisi posteriore o neuro-ipofisi), strutturalmente e funzionalmente diversi, che controllano, attraverso la secrezione di numerosi ormoni, l’attività endocrina e metabolica di tutto l’organismo. I differenti processi vengono modulati da diversi segnali, che intervengono in sequenza:
- per la fase di differenziazione: FGF-R1/FGF-8 (fibroblast growth factor receptor 1 e fibroblast growth factor 8), NELF (Nasal Embryonic LH-releasing hormone Factor) e HS6ST1 (heparan sulphate 6-O-sulphotransferase);
- per la fase di migrazione dei neuroni GnRH-secernenti verso l’ipotalamo: Kal 1, il complesso PORPK2/PROKR2 (Prokinecitina 2 e il suo recettore) e CHD7 (chromodomain helicase DNA-binding protein 7);
- nella regolazione stimolante nei neuroni GnRH-secernenti: TAC3/TACR3 (tachichinina 3 e il suo recettore) e KISS1/KISSR1 (kisspeptina 1 con il suo recettore). Quest’ultimo gene è indispensabile per l’attivazione della pubertà.
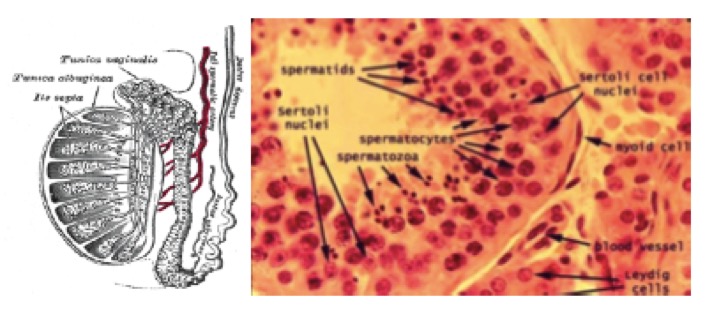
I testicoli, o didimi, costituiscono le gonadi maschili. Hanno la funzione principale di produrre gli spermatozoi e alcuni ormoni, fra i quali il testosterone. Sono organi di forma ovale, misurano 3.5-5.5 centimetri di lunghezza, 3 centimetri circa di larghezza e 3 centimetri circa trasversalmente. Il peso del testicolo dell’adulto è di circa 30 grammi (fig 2). Il testicolo è avvolto dalla tunica albuginea, dalla cui faccia profonda si dipartono i setti convergenti verso il mediastino testicolare, che delimitano il parenchima testicolare in circa 300 logge di forma piramidale. Il parenchima è costituito dai tubuli seminiferi, deputati alla produzione di spermatozoi, e dallo stroma, che circonda i tubuli e che contiene le cellule di Leydig a funzione endocrina.
Figura 2. Anatomia testicolare (da Gray’s Anatomy. Elsevier, 2009)
Fisiologia dell’asse GnRH-Gn-T
I neuroni che costituiscono l’ipotalamo producono sostanze attive di natura polipeptidica, chiamate ormoni di rilascio (releasing hormones o RH), che agiscono sulle cellule dell’adeno-ipofisi, stimolandole in maniera specifica a produrre i rispettivi ormoni. In particolare, l’ormone di liberazione delle gonadotropine (GnRH), un decapetide codificato da un gene localizzato sul braccio corto del cromosoma 8, agisce sulle cellule gonadotrope ipofisarie, stimolandole alla secrezione dell’ormone luteinizzante (luteinizing hormone, LH) e dell’ormone follicolo-stimolante (follicle-stimulating hormone, FSH). La secrezione del GnRH è di tipo pulsatile, e questo rappresenta un pre-requisito fondamentale per la corretta funzione riproduttiva.
FSH ed LH, prodotti rispettivamente dalle cellule beta e gamma dell’adeno-ipofisi, agiscono sui testicoli. L’FSH agisce promuovendo le prime fasi maturative della spermatogenesi e favorendo la sintesi della proteina che lega il testosterone (ABP), mentre l’LH ha il compito di stimolare le fasi finali della spermatogenesi e la secrezione testicolare di ormoni.
Altri ormoni che nel maschio esercitano un’azione a carico dell’asse sono l’inibina B, l’INSL3, e la prolattina (PRL).
L’inibina B è un ormone gonadotropino-dipendente prodotto dalle cellule di Sertoli e da alcuni tipi di cellule spermatogenetiche, che esercita il feed-back negativo da parte del testicolo sulla produzione di FSH. I valori di inibina B sono direttamente proporzionali alla funzione spermatogenetica e sono bassi o indosabili nei soggetti con ipogonadismo da testicolopatia primaria.
L’insulin-like factor 3 (INSL3) è un membro della famiglia degli ormoni simili alla relaxina, prodotto dalle cellule di Leydig. Oltre a causare la discesa dei testicoli durante lo sviluppo embrionale, INSL3 è coinvolto anche in altre vie di signaling endocrino e paracrino nei maschi adulti. Infatti, INSL-3 agisce come ormone ad azione androgenica in vari distretti corporei e in particolare svolge un ruolo chiave nel metabolismo osseo. Infine esso ha effetto inibitorio simile a quello del testosterone a livello centrale.
La PRL è un ormone polipeptico secreto dall’adenoipofisi ma, a differenza delle gonadotropine, non è chiaro quale sia la funzione fisiologica nel maschio, dove ha esclusivamente attività inibitorie a livello centrale, influenzando negativamente la capacità riproduttiva e la funzione sessuale. La PRL tende a elevarsi anche in condizioni di stress acuto e pertanto queste condizioni vanno distinte da quelle in cui la presenza di un adenoma ipofisario PRL-secernente mantiene costantemente elevati i livelli di questo ormone.
Patologie dell’asse GnRH-Gn-T.
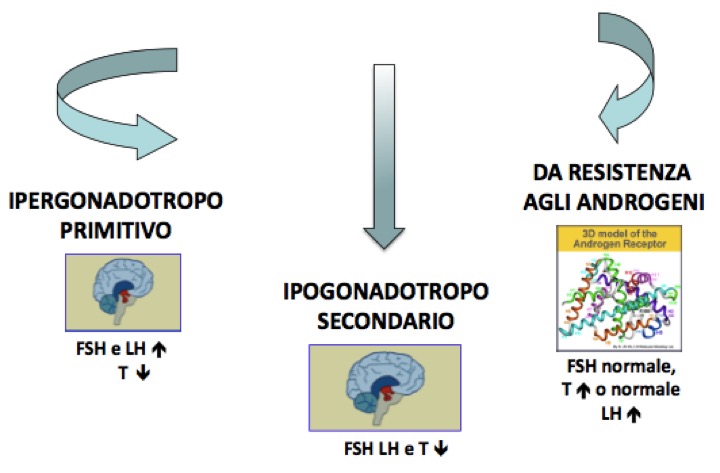
Le patologie dello sviluppo e della funzione dell’asse ipotalamo-ipofisi-testicolo portano ad alterazioni della funzione testicolare e sono pertanto responsabili dell’ipogonadismo, definito come una sindrome clinica che origina dall’insufficiente capacità del testicolo di produrre livelli fisiologici di testosterone e di spermatozoi a causa dell’alterazione a uno o più livelli dell’asse. Tale condizione può avere cause differenti e manifestarsi in diverse forme a seconda del periodo di insorgenza. Dal punto di vista patogenetico, gli ipogonadismi possono essere distinti in tre forme (fig 3):
- primitivi o ipergonadotropi, nei quali l’alterazione a carico delle cellule di Leydig compromette la produzione di androgeni (testosterone) e/o altera i tubuli seminiferi, con conseguente oligospermia o azoospermia. Queste forme sono caratterizzate da elevati livelli di gonadotropine e basse concentrazioni di testosterone;
- secondari o ipogonadotropi, nei quali alterazioni dell’ipotalamo o dell’ipofisi compromettono la secrezione delle gonadotropine e di conseguenza la funzione testicolare. In questi pazienti vengono osservati ridotti livelli di gonadotropine e di testosterone;
- da alterata risposta agli androgeni, nei quali, a causa di un’alterazione della proteina recettore o per difetti enzimatici, la risposta agli androgeni prodotti dal testicolo è ridotta o assente. Questi casi sono caratterizzati da normali livelli di FSH con elevate concentrazioni di LH e testosterone normale o elevato.
Figura 3. I diversi tipi di ipogonadismo in reazione alla patogenesi
Bibliografia
- Fraietta R, Zylberstejn DS, Esteves SC. Hypogonadotropic hypogonadism revisited. Clinics (Sao Paulo) 2013, 68 suppl 1: 81-8.
- Foresta C. Infertilità maschile, fisiopatologia, clinica, diagnostica e terapia. CLEUP Padova 2009.
- Faiman C. Male hypogonadism. Cleveland Clinic Continuing Education 2012.